En bref
Les cancers sont composés non seulement de cellules tumorales, mais également de l'environnement tumoral (TME), qui se compose de nombreux types différents de cellules normales et de la matrice extracellulaire - un réseau de protéines et de glucides qui assure la structure et contrôle le développement et la fonction des tissus. L'environnement tumoral évolue en symbiose avec les cellules cancéreuses et influence fortement toutes les étapes de la progression, des stades les plus précoces au développement de métastases et à la résistance thérapeutique. Parmi les composants les plus importants de l'environnement tumoral figurent diverses cellules du système immunitaire. Bien qu'initialement une barrière à la formation de cancer, les cellules cancéreuses orchestrent un réseau complexe d'interactions au sein de l'environnement tumoral pour échapper à la surveillance et à l'élimination par les cellules immunitaires, et même coopter certaines cellules immunitaires pour favoriser leur croissance et leur progression. La composition et les propriétés physiques (comme la rigidité) de la matrice extracellulaire changent également de manière significative au cours de la progression tumorale, fournissant des indices importants qui contrôlent le comportement des cellules cancéreuses et normales au sein de l'environnement tumoral.
L'ICG a été essentiel pour révéler l'importance de l'environnement tumoral pendant le développement tumoral, l'établissant comme une source de puissants biomarqueurs et de cibles thérapeutiques au potentiel considérable. Des découvertes récentes ont également montré que l'environnement tumoral médiatise l'influence de facteurs physiologiques et environnementaux plus larges, tels que l'alimentation et le poids corporel, sur l'initiation du cancer, sa progression et la réponse thérapeutique. En utilisant une technologie avancée, les chercheur.es de l'ICG étudient comment l'environnement tumoral évolue et révèlent les mécanismes sous-jacents à son influence sur la biologie et les résultats du cancer. Nous avons développé des modèles génétiquement modifiés innovants pour étudier l'environnement tumoral. et des méthodes uniques pour le recréer en laboratoire, nous permettant de comprendre son fonctionnement à un niveau fondamental. En combinant ces approches avec nos solides liens avec la clinique, nous sommes en mesure de découvrir de nouvelles stratégies de médecine de précision exploitant l'environnement tumoral pour améliorer la thérapie contre le cancer.
Domaines d'intérêt
Immunologie des tumeurs et l'immunothérapie. En exploitant le pouvoir du système immunitaire du patient pour attaquer et détruire les tumeurs, les immunothérapies peuvent induire des réponses hautement durables, voire des guérisons, dans certains types de cancer qui ont généralement un pronostic très sombre. Néanmoins, ces nouvelles thérapies révolutionnaires sont affectées par les mêmes problèmes qui ont limité d'autres stratégies de médecine de précision jusqu'à présent - des sous-ensembles de tumeurs ne répondent pas, et une résistance se développe dans la plupart des cas où une réponse initiale est obtenue. La recherche à l'ICG se concentre sur la découverte des mécanismes que les cancers utilisent pour résister à l'immunothérapie et sur l'identification de biomarqueurs qui peuvent renforcer la prise de décision clinique, permettant aux patients ayant les meilleures réponses de recevoir une immunothérapie, tandis que ceux dont les tumeurs sont prêtes à résister peuvent être épargnés des effets secondaires inutiles. Nous utilisons notre technologie puissante pour cartographier spatialement les données "omiques" afin de révéler la topographie de la réponse immunitaire au sein du tissu cancéreux, en identifiant les caractéristiques clés différenciant la réponse à l'immunothérapie de la résistance et en découvrant de puissants biomarqueurs prédictifs. Nos programmes de recherche visent à identifier la prochaine génération de cibles immunothérapeutiques parmi les réseaux d'interactions cellule tumorale / immunitaire, et à découvrir des stratégies pour améliorer l'immunothérapie en exploitant l'influence de l'alimentation, du microbiome et de la durée et du timing du traitement, y compris en comparant les effets des doses continues et intermittentes et en définissant le rôle de la chronobiologie (les mécanismes sous-jacents aux phénomènes liés au temps tels que les rythmes circadiens) dans la réponse à l'immunothérapie.
Immunité innée, inflammation et cancer. Une réponse biologique complexe connue sous le nom d'inflammation fait partie normalement de la réponse du corps aux blessures, de ses défenses contre les infections et du processus de cicatrisation, entre autres rôles importants. Elle implique des populations spécifiques de cellules immunitaires, en particulier celles désignées comme cellules immunitaires innées, ainsi que des changements dans la vascularisation et la matrice extracellulaire, et toute une gamme de facteurs de croissance, de cytokines et d'autres médiateurs de la communication intercellulaire. L'inflammation prend généralement fin lorsque la source de la blessure est éliminée. Cependant, le développement d'une tumeur déclenche une réponse inflammatoire soutenue connue sous le nom d'inflammation chronique, caractérisée par différentes populations de cellules immunitaires innées, un spectre différent de facteurs solubles et différents effets sur la structure tissulaire et les cellules stromales par rapport aux réponses inflammatoires aiguës. Les tumeurs peuvent promouvoir activement une inflammation chronique en libérant des molécules telles que les cytokines, en plus d'endommager les tissus locaux à mesure qu'elles se développent. L'inflammation chronique favorise la croissance tumorale en stimulant le développement d'un réseau sanguin (angiogenèse), en interférant avec les réponses immunitaires qui suppriment les premiers stades des cancers, et en fournissant des signaux qui stimulent la prolifération et la survie des cellules tumorales. Les conditions de santé qui favorisent l'inflammation systémique et chronique prédisposent au développement du cancer et peuvent accélérer la progression tumorale. Les chercheur.es de l'ICG utilisent des modèles génétiques et des analyses avancées d'échantillons de patients pour comprendre les relations complexes entre le système immunitaire inné, l'inflammation et le cancer. Travaillant au sein de réseaux nationaux et internationaux, notamment ceux financés par Cancer Research UK, le Brain Tumor Funders' Collaborative et le programme TRANSCAN financé par l'UE, nous cartographions les réponses immunitaires et inflammatoires innées pour une gamme de cancers à pronostic défavorable afin de révéler de nouvelles stratégies thérapeutiques ciblant l'inflammation associée au cancer.
L'environnement du tissu adipeux contient un réseau d'adipocytes (cellules graisseuses), de cellules immunitaires et d'autres types de cellules qui régulent le métabolisme et le poids corporel. Pour les cancers se développant dans des tissus avec une composante adipeuse, notamment les principaux types de cancer tels que le cancer du sein, ce réseau joue un rôle majeur dans la progression. Il influence toute une gamme d'interactions métaboliques, notamment l'apport de nutriments aux cellules tumorales par les adipocytes et la compétition pour les nutriments entre les cellules tumorales et immunitaires dans le microenvironnement. Une autre communication intercellulaire affectant la progression tumorale se produit par la libération de facteurs solubles, notamment des cytokines, des facteurs de croissance et des adipokines (cytokines sécrétées spécifiquement par le tissu adipeux) dans le microenvironnement. Cependant, l'impact du tissu adipeux sur le développement du cancer ne se limite pas aux effets locaux. Pendant l'obésité, la structure normale du tissu adipeux se dégrade et le tissu adipeux blanc (WAT) s'accumule tandis que le tissu adipeux brun (BAT), qui dissipe l'énergie des macronutriments sous forme de chaleur via la thermogenèse, est perdu. Le stress tissulaire causé par l'accumulation excessive de lipides dans le WAT conduit à une inflammation chronique, augmente les niveaux circulants d'acides gras libres et de facteurs pro-inflammatoires, et perturbe la fonction du système immunitaire. Ces changements systémiques sont associés à l'initiation et à la progression tumorale dans de nombreux types de cancer. Leurs conséquences dépassent également largement le cancer, constituant une barrière à un vieillissement sain et augmentant l'incidence de maladies chroniques à forte charge, notamment les maladies cardiovasculaires, les AVC et le diabète de type 2, ainsi que les maladies infectieuses. L'ICG a développé des ressources de pointe à l'échelle mondiale pour modéliser précliniquement les effets de la biologie des adipocytes, de l'obésité et de la thermogenèse sur le cancer. Elles comprennent des modèles génétiquement modifiés puissants et des outils pour révéler les mécanismes de contrôle génétique et métabolique qui dictent la fonction des adipocytes, ainsi que des modèles de référence pour étudier les rôles de l'alimentation et du poids corporel. Nous utilisons nos pipelines uniques pour l'analyse spatiale des cellules individuelles pour caractériser de manière exhaustive la composition cellulaire et l'architecture de l'environnement du tissue adipeux et déterminer comment les adipocytes communiquent avec les cellules tumorales et gouvernent les réseaux d'interactions cellulaires, ou "quartiers" topographiques, qui influencent la progression et la réponse thérapeutique.
Membres de l'équipe
Nos découvertes
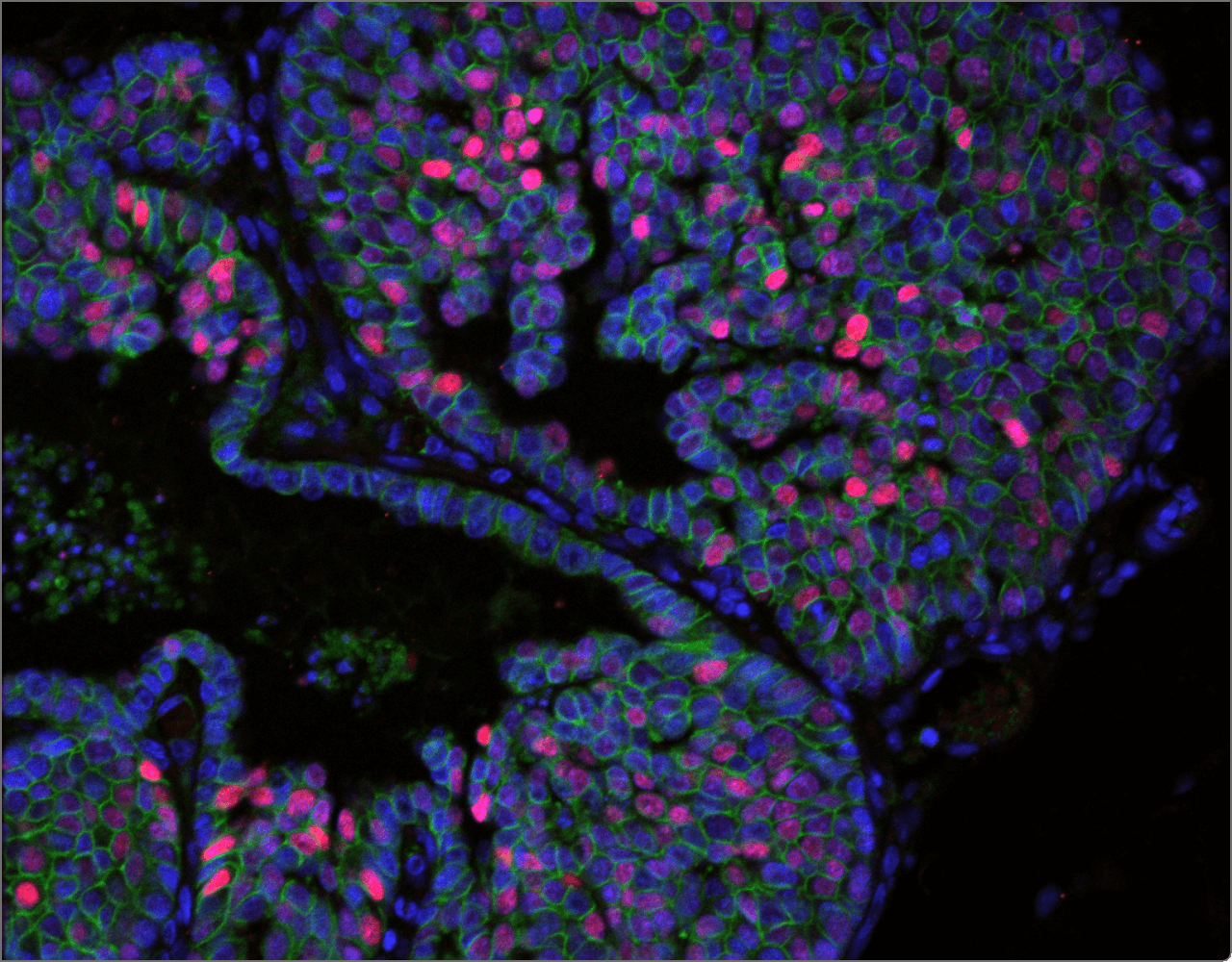
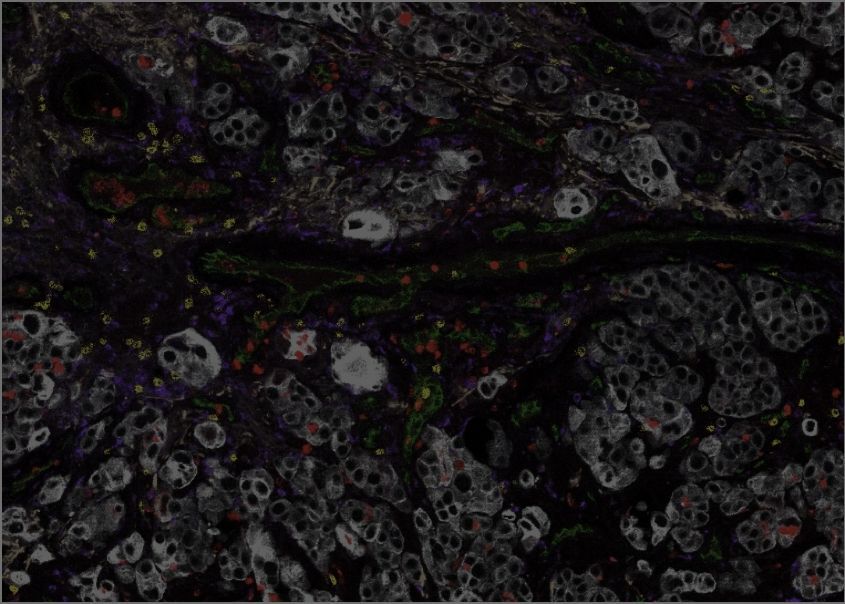
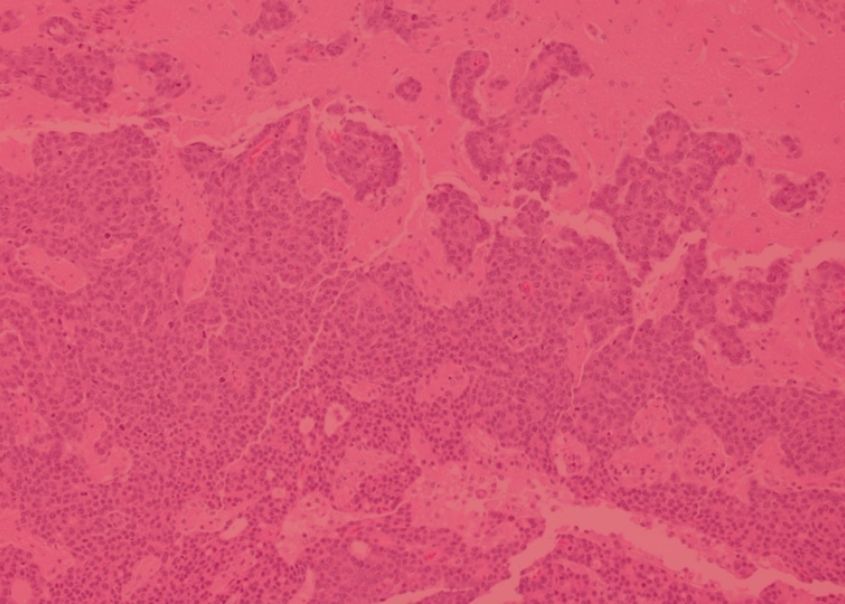
La recherche de l'ICG a été cruciale pour établir l'importance du microenvironnement dans le cancer du sein. Nous avons été parmi les premiers à établir que le microenvironnement est une source de biomarqueurs pouvant prédire l'évolution du cancer du sein, et notre imagerie de pointe et nos analyses ont révélé l'organisation spatiale de la réponse immunitaire dans le cancer du sein, y compris la présence de sous-types du microenvironnement immunitaire associés à des caractéristiques spécifiques de la biologie du cancer du sein et pouvant prédire les résultats cliniques.
Finak, G. et al. Stromal gene expression predicts clinical outcome in breast cancer. Nat Med. 2008 May;14(5):518-27. doi: 10.1038/nm1764. Epub 2008 Apr 27. PMID: 18438415
Saleh SMI, et al. Identification of Interacting Stromal Axes in Triple-Negative Breast Cancer. Cancer Res. 2017 Sep 1;77(17):4673-4683. doi: 10.1158/0008-5472.CAN-16-3427. Epub 2017 Jun 26. PMID: 28652250
Gruosso, T. et al. Spatially distinct tumor immune microenvironments stratify triple-negative breast cancers. J Clin Invest. 2019 Apr 1;129(4):1785-1800. doi: 10.1172/JCI96313. Epub 2019 Mar 18. PMID: 30753167
Grâce à nos rôles de premier plan dans les réseaux de recherche clinique et translationnelle, nous utilisons les plates-formes avancées de l'ICG pour l'analyse spatialement résolue des cellules uniques afin de révéler l'organisation de la réponse immunitaire dans le cancer humain avec un niveau de détail sans précédent. Des études menées par des chercheur.es de l'ICG ont utilisé cette technologie pour trouver des relations spatiales et des "voisinages" cellulaires qui corroborent avec les réponses et les résultats dans les mélanomes métastatiques et les cancers du poumon récurrents traités par l'immunothérapie. Ces découvertes conduisent à de nouveaux biomarqueurs innovants qui amélioreront considérablement la médecine de précision, permettant aux cliniciens de maximiser les bénéfices de l'immunothérapie pour les patients prédisposés à répondre, tout en épargnant aux autres les effets secondaires inutiles.
Moldoveanu D, et al. Spatially mapping the immune landscape of melanoma using imaging mass cytometry. Sci Immunol. 2022 Apr;7(70):eabi5072. doi: 10.1126/sciimmunol.abi5072. Epub 2022 Apr 1.PMID: 35363543
Sorin, M. et al., Single-cell spatial landscape of immunotherapy response reveals mechanisms of CXCL13 enhanced antitumor immunity. J Immunother Cancer. 2023 Feb;11(2):e005545. doi: 10.1136/jitc-2022-005545. PMID: 3672508
Les chercheur.es de l'ICG figurent parmi les leaders mondiaux dans la compréhension des rôles associés au cancer des cellules myéloïdes (cellules du système immunitaire inné se formant et mûrissant dans la moelle osseuse). Un projet international sous notre direction, soutenu par la Brain Tumor Funders' Collaborative, a utilisé la plate-forme unique d'analyse spatiale à cellules uniques de l'ICG pour révéler que la présence d'une population unique de macrophages, un type de cellule myéloïde, était associée à de meilleurs résultats cliniques dans le cancer du cerveau. Le travail effectué à l'ICG a également montré que des cellules myéloïdes appelées neutrophiles sont des médiateurs cruciaux de la métastase du cancer du sein vers les poumons dans le contexte de l'obésité. Nous avons découvert les propriétés métaboliques de sous-populations de neutrophiles qui favorisent la métastase du cancer du sein vers le foie, et avec nos membres du corps professoral et nos partenaires, nous révélons comment les pièges extracellulaires de neutrophiles (NET), des structures contenant de l'ADN et des protéines libérées par les neutrophiles, sont impliqués dans la progression tumorale. Ce travail conduit à de nouvelles stratégies thérapeutiques prometteuses pour perturber les fonctions favorisant le cancer des cellules myéloïdes.
Karimi E, et al. Single-cell spatial immune landscapes of primary and metastatic brain tumours. Nature. 2023 Feb;614(7948):555-563. doi: 10.1038/s41586-022-05680-3. Epub 2023 Feb 1. PMID: 3672593
McDowell SAC, et al. Neutrophil oxidative stress mediates obesity-associated vascular dysfunction and metastatic transmigration. Nat Cancer. 2021 May;2(5):545-562. doi: 10.1038/s43018-021-00194-9. Epub 2021 May 3. PMID: 3512201
Hsu BE, et al. Immature Low-Density Neutrophils Exhibit Metabolic Flexibility that Facilitates Breast Cancer Liver Metastasis. Cell Rep. 2019 Jun 25;27(13):3902-3915.e6. doi: 10.1016/j.celrep.2019.05.091.PMID: 31242422
Rayes RF, et al. Primary tumors induce neutrophil extracellular traps with targetable metastasis promoting effects. JCI Insight. 2019 Jul 25;5(16):e128008. doi: 10.1172/jci.insight.128008. PMID: 31343990
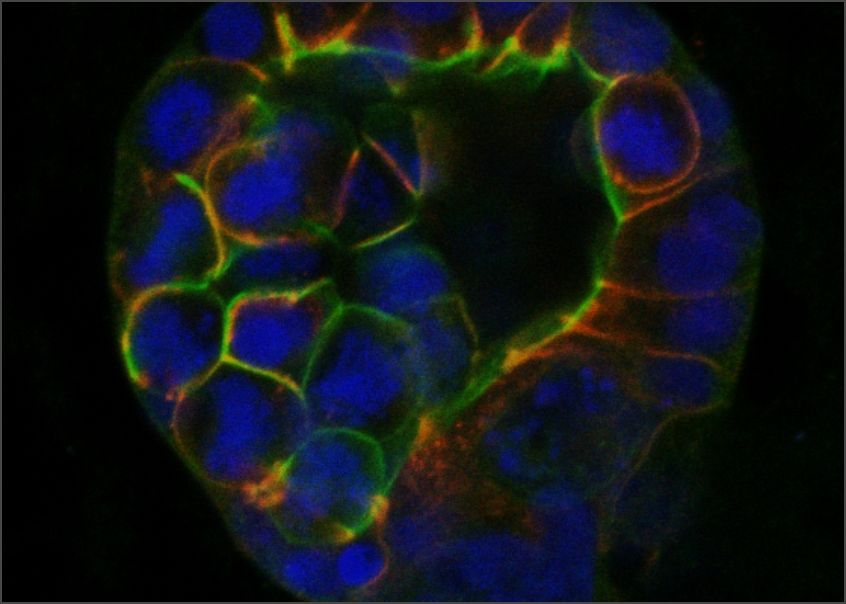
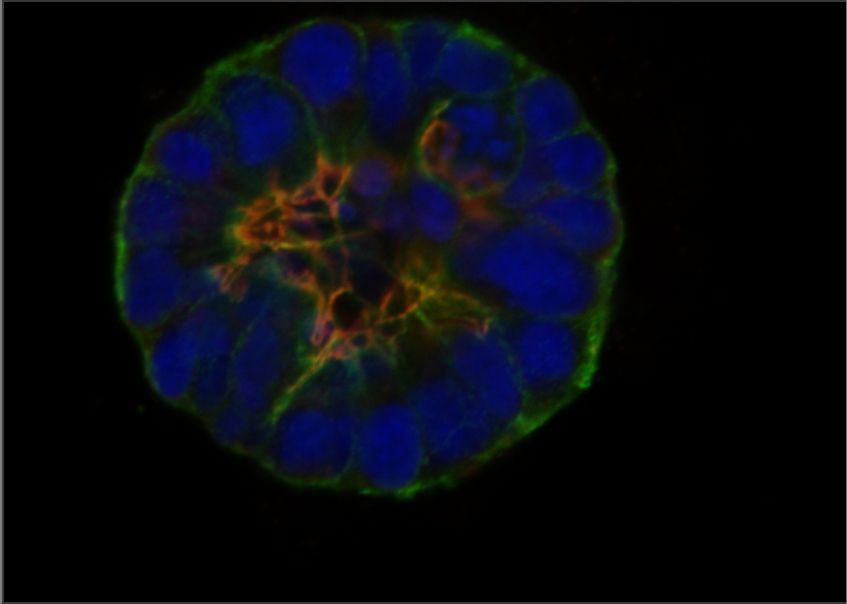
Une des façons les plus importantes pour les cellules d'interagir avec leur microenvironnement est par le biais d'une classe de protéines appelées intégrines, qui reconnaissent et se lient à des composants spécifiques de la matrice extracellulaire (MEC). Les intégrines ont des fonctions cruciales dans les cellules cancéreuses, où elles transmettent des signaux de l'environnement qui influencent la croissance cellulaire et la division, la survie, et des étapes importantes de la métastase. Les chercheur.es de l'ICG ont été parmi les premiers à utiliser le génie génétique pour révéler l'implication des protéines d'intégrine dans la progression du cancer du sein, y compris leur rôle dans la détermination si les cancers émergents progressent ou entrent dans un état d'arrêt de croissance connu sous le nom de dormance. Nous avons également développé de nouvelles approches sophistiquées, en collaboration avec des ingénieurs chimiques et biologiques, pour modéliser les changements associés au cancer dans la matrice extracellulaire en laboratoire, nous permettant d'étudier les mécanismes fondamentaux liant ces changements à la progression du cancer.
White, D. et al. Targeted disruption of beta1-integrin in a transgenic mouse model of human breast cancer reveals an essential role in mammary tumor induction. Cancer Cell. 2004 Aug;6(2):159-70. doi: 10.1016/j.ccr.2004.06.025. PMID: 15324699
Bui, T. et al. Functional Redundancy between β1 and β3 Integrin in Activating the IR/Akt/mTORC1 Signaling Axis to Promote ErbB2-Driven Breast Cancer. Cell Rep. 2019 Oct 15;29(3):589-602.e6. doi: 10.1016/j.celrep.2019.09.004. PMID: 31618629
Bui, T. et al. Emergence of β1 integrin-deficient breast tumours from dormancy involves both inactivation of p53 and generation of a permissive tumour microenvironment. Bui T, Gu Y, Ancot F, Sanguin-Gendreau V, Zuo D, Muller WJ. Oncogene. 2022 Jan;41(4):527-537. doi: 10.1038/s41388-021-02107-7. Epub 2021 Nov 15. PMID: 34782719
Mok S, et al. Mapping cellular-scale internal mechanics in 3D tissues with thermally responsive hydrogel probes. Nat Commun. 2020 Sep 21;11(1):4757. doi: 10.1038/s41467-020-18469-7. PMID: 32958771